Fusarium, il fungo che sfida l'efficienza dell'industria della carne
L'industria globale delle proteine attraversa una fase di esaurimento silenzioso. Durante l'ultimo decennio, la risposta dominante alla crisi ambientale ed etica dell'allevamento è stata la proliferazione di prodotti vegetali che imitano la carne: hamburger di piselli, salsicce di soia, matrici di amido e aromi ricostruiti in laboratorio. Sono riusciti a ridurre le emissioni e ad aprire il dibattito, ma non hanno convinto tutti. Né il palato, né i sistemi agricoli, né i bilanci energetici.
In questo contesto, la scienza ha iniziato a guardare con maggiore attenzione a un territorio che non è né animale né vegetale: il regno dei funghi (fungi). Non come una moda culinaria, ma come una piattaforma biotecnologica matura, capace di produrre proteine di alta qualità con un'efficienza metabolica che l'agricoltura tradizionale non può eguagliare.

Il punto di svolta è arrivato nel novembre 2025. Un team di ricercatori dell'Università di Jiangnan (Cina), guidato dal dottor Xiao Liu, ha pubblicato su Trends in Biotechnology un progresso che cambia le regole del gioco. Utilizzando l'editing genetico di precisione, sono riuscuti a ottimizzare il fungo Fusarium venenatum per trasformarlo in una fonte di proteine significativamente più produttiva ed economica. Non si è trattato di una promessa futuristica, ma di uno sblocco molecolare concreto con risultati immediati.
Riprogettare il metabolismo fungino
La micoproteina non è una scoperta recente né una risposta improvvisata all'ansia climatica. Fusarium venenatum è una vecchia conoscenza identificata come candidato alimentare già negli anni settanta, in un contesto segnato da crisi energetiche e timore di carenze. Quando arrivò sul mercato negli anni ottanta (sotto marchi come Quorn), la sua proposta era radicale per l'epoca: produrre proteine in serbatoi di fermentazione, senza campi, senza pascoli e senza animali.
Tuttavia, quella prima generazione arrivò con delle limitazioni. La sua produzione industriale si è sempre scontrata con un limite biologico: la velocità con cui il fungo può assimilare i nutrienti, specificamente l'azoto. Per decenni, il Fusarium è sopravvissuto come una soluzione di nicchia, con costi elevati e un'efficienza che non riusciva a decollare.
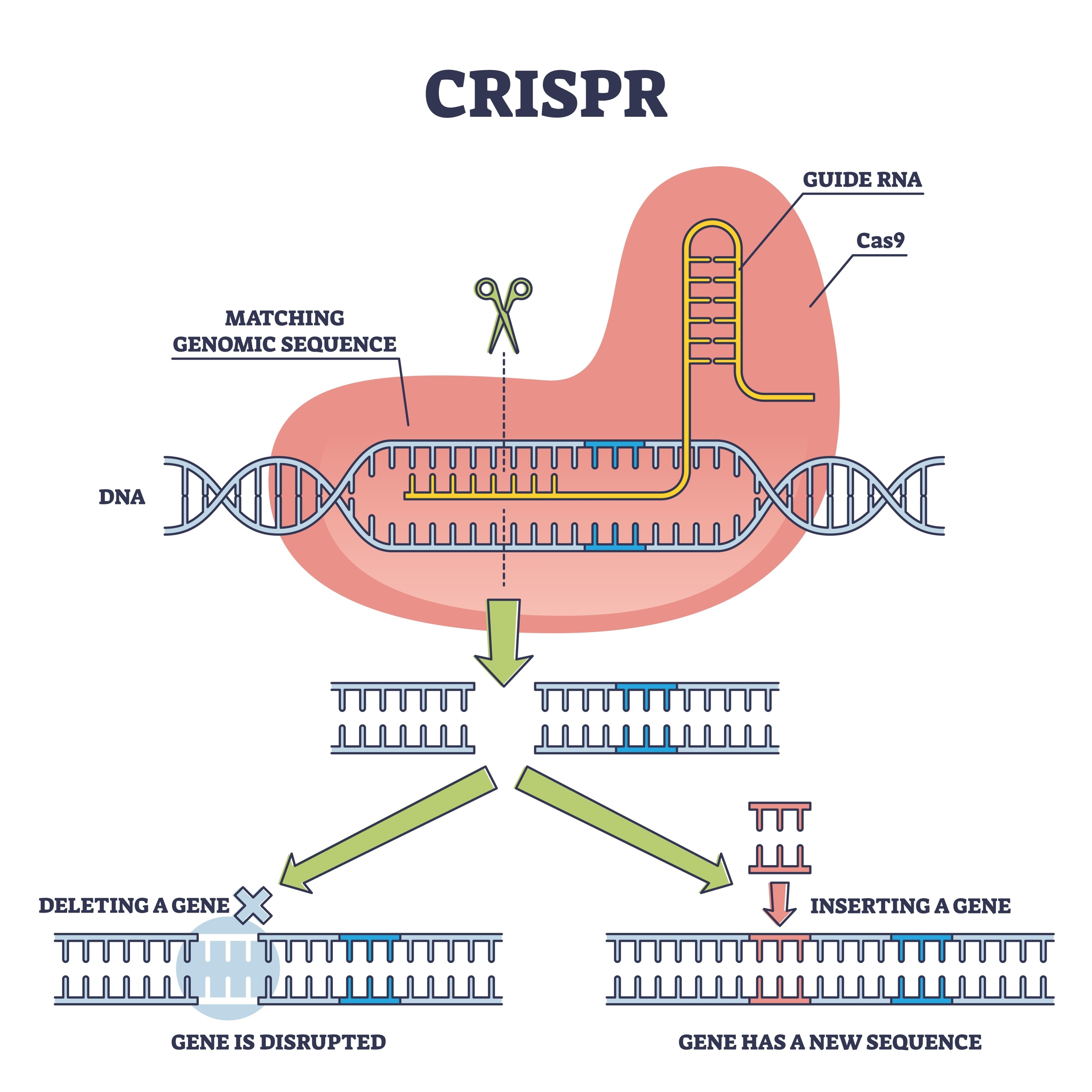
È qui che entra in gioco il team di Xiao Liu, recuperando questa tecnologia per metterla in condizioni di competere. Hanno optato per una strategia di "cisgenesi". A differenza dei transgenici classici, dove si introduce DNA di altre specie, qui è stato utilizzato lo strumento CRISPR-Cas9 per modificare geni che esistevano già nel fungo. L'obiettivo era una famiglia genica specifica: glnA, responsabile della produzione della glutamina sintetasi. Questo enzima agisce come un "guardiano" metabolico; nel ceppo selvatico, limita la quantità di azoto che il fungo assorbe per costruire proteine.
Modificando i promotori di questi geni, i ricercatori sono riusciti a togliere il "freno a mano" all'organismo. Il risultato è un fungo che ottimizza il suo metabolismo interno per smettere di regolare la sua crescita al ribasso, convertendo i nutrienti in biomassa con una voracità inedita.
Aumento della biomassa e riduzione dei costi
Nell'industria alimentare, la sostenibilità è un'equazione matematica. Se il prodotto finale è costoso o lento da produrre, non sostituirà la carne. I risultati presentati dall'Università di Jiangnan attaccano proprio questa equazione con cifre convincenti:
- Esplosione della crescita (+88%): In condizioni di coltura identiche, il ceppo modificato raddoppia quasi la sua biomassa rispetto alla variante naturale. Ciò consente agli impianti di fermentazione di raddoppiare la produzione senza dover costruire nuovi bioreattori, riducendo drasticamente l'investimento di capitale necessario.
- Risparmio di risorse (-44%): Il fungo modificato ha necessitato di quasi la metà dello zucchero per crescere. Dato che il terreno di coltura (il "cibo" del fungo) rappresenta uno dei maggiori costi operativi, questa efficienza è la chiave per raggiungere la parità di prezzo con la carne industriale a basso costo.
Se contestualizziamo questi dati, l'abisso con l'allevamento si allarga. La produzione di questa micoproteina emette tra il 60 e il 70% in meno di gas serra rispetto al manzo ed elimina dall'equazione la deforestazione e il consumo massiccio di acqua. È proteina industrializzata, sì, ma senza la zavorra ecologica del modello carneo tradizionale.

Tuttavia, l'efficienza non è una promessa automatica. Nella biotecnologia, i risultati di laboratorio non sempre sopravvivono al salto su scala industriale. Un organismo che cresce con voracità in condizioni controllate può comportarsi in modo imprevedibile in fermentatori da centinaia di migliaia di litri, sottoposti a variazioni di temperatura, ossigenazione e stress metabolico prolungato.
Gli stessi autori dello studio sottolineano che la prossima sfida sarà valutare la stabilità genetica del ceppo modificato a lungo termine, così come il suo comportamento in cicli continui di produzione. La storia della biotecnologia alimentare è piena di progressi brillanti che hanno fallito non per mancanza di scienza, ma per limiti pratici. Questo Fusarium ha guadagnato velocità; ora deve dimostrare resistenza.
Ma produrre più proteine non serve a nulla se il corpo umano non può sfruttarle. Ed è qui che la biologia del fungo poneva, fino ad ora, uno dei suoi limiti più grandi.
Più nutriente e digeribile: come l'editing genetico ridisegna la fibra fungina
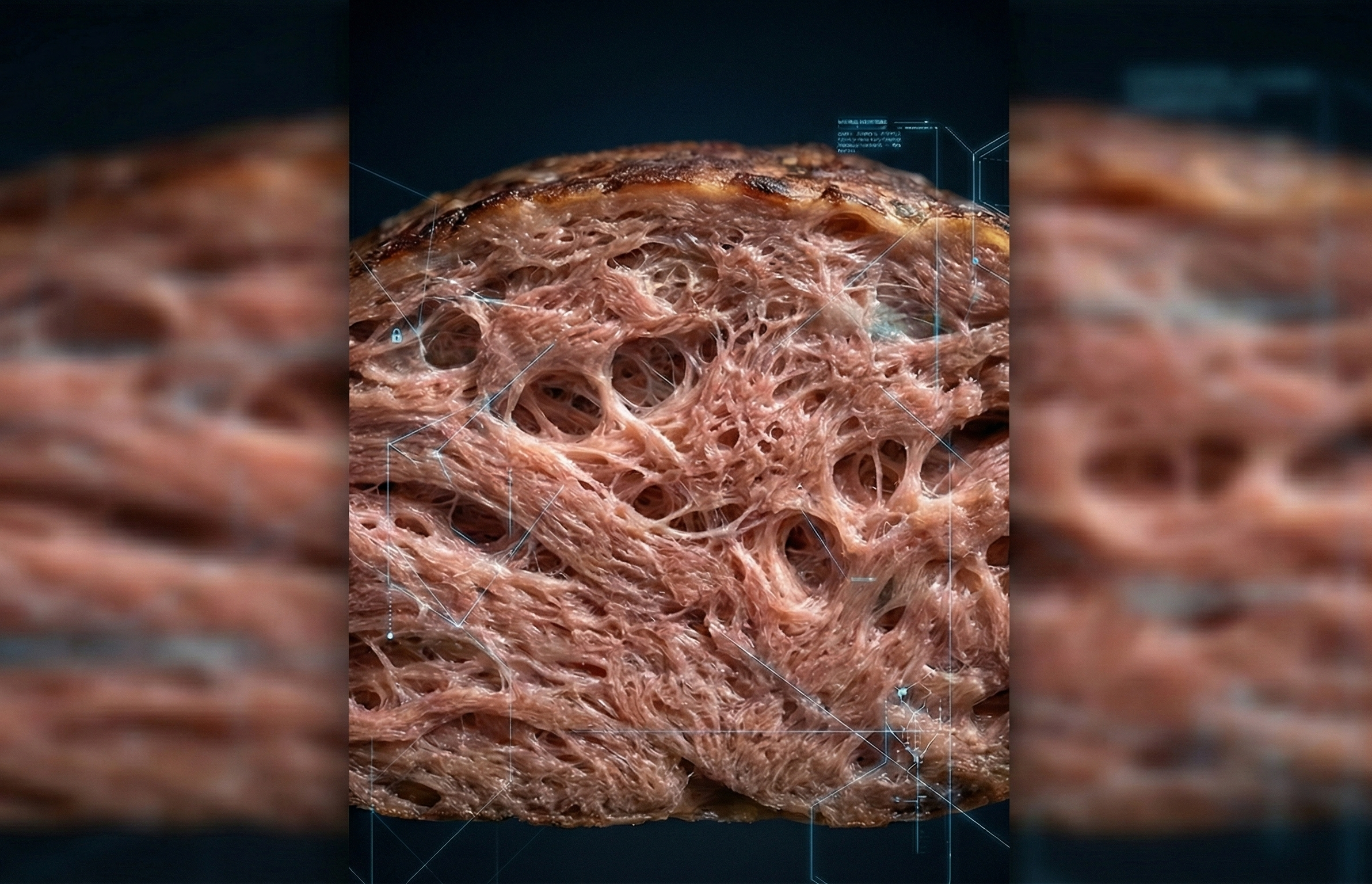
Il consumatore non compra proteine; compra esperienza. Fibra, morso, succosità. È qui che la biologia del fungo offre un vantaggio strutturale: cresce formando ife, filamenti microscopici che imitano naturalmente la disposizione delle fibre muscolari animali.
Tuttavia, quell'architettura aveva un prezzo nascosto: la biodisponibilità. Le cellule dei funghi sono protette da pareti rigide di chitina — lo stesso materiale dell'esoscheletro degli insetti. Fino ad ora, per il sistema digestivo umano, rompere quell'"armatura" risultava complesso, impedendo l'accesso a gran parte delle proteine che il fungo immagazzina al suo interno. Avevamo un alimento ricco in teoria, ma non sempre sfruttato con l'efficienza che la sua composizione prometteva.
Il team di Jiangnan ha affrontato questo ostacolo con un secondo ciclo di editing genetico, parallelo a quello della crescita. Hanno eliminato i geni associati alla chitina sintasi, riducendo significativamente lo spessore della parete cellulare.
Il risultato è un equilibrio biotecnologico delicato: le ife mantengono la loro struttura intrecciata (preservando la consistenza carnea), ma i loro muri difensivi sono ora più sottili. "Snellendo" quella barriera, i ricercatori hanno liberato la proteina intracellulare affinché il nostro corpo possa assorbirla realmente. Non è più solo un alimento che "riempie" per la sua fibra, ma uno che nutre con l'efficienza promessa.
Sebbene lo studio di Liu si sia concentrato su crescita e digeribilità, il campo avanza verso il sapore. Altre ricerche recenti utilizzano tecniche simili per indurre la produzione di emoproteine — responsabili del gusto metallico della carne —, promettendo di chiudere il divario sensoriale definitivo tra il fermentatore e il macello.
Scalabilità industriale e quadro normativo
Non è un caso che questo progresso provenga dalla Cina. Nell'ultimo decennio, il paese ha identificato la fermentazione di precisione come una tecnologia strategica, capace di ridurre la sua dipendenza dalle importazioni agricole e ammortizzare la volatilità dei mercati globali delle proteine.
La proteina fungina non compete solo con la carne: compete con il modello agricolo estensivo, con la logistica globale e con la geopolitica del cibo. Su quella scacchiera, i bioreattori diventano infrastrutture critiche quanto i silos di grano o i porti commerciali.

Il progresso scientifico è innegabile, ma la strada verso il supermercato passa per la burocrazia. Tuttavia, la tecnica scelta dal team di Xiao Liu potrebbe facilitare il processo. Non incorporando DNA esogeno, questi funghi si collocano in una zona normativa favorevole in regioni come gli Stati Uniti e, sempre più, nell'Unione Europea, dove si inizia a distinguere tra organismi geneticamente modificati (OGM) classici e organismi editati (NGT). La logica è che, non introducendo materiale genetico di specie estranee, il risultato finale è considerato biologicamente equivalente a una mutazione che avrebbe potuto verificarsi in natura. Ciò consente di evitare i protocolli di sicurezza rigorosi e costosi richiesti per i transgenici classici.
In un impianto di fermentazione, non ci sono prati né recinti. Solo serbatoi d'acciaio, tubature e un mormorio costante di liquidi in movimento. Il fungo cresce senza vedere la luce del sole, trasformando zuccheri e azoto in fibre commestibili con un'efficienza che nessun animale può replicare. Non c'è macellazione né epica rurale: solo metabolismo ottimizzato.
Forse è questo il motivo per cui questa rivoluzione avanza in silenzio. Non fa appello alla nostalgia né all'emozione, ma a una domanda scomoda: cosa siamo disposti a lasciarci alle spalle per continuare a nutrirci senza esaurire il pianeta.
In un mondo che si avvicina ai dieci miliardi di abitanti, la domanda forse non è se accetteremo di mangiare funghi, ma quali altre idee sul cibo dovremo abbandonare per continuare a nutrirci senza esaurire il pianeta. La proposta di Liu offre una soluzione sobria: proteine abbondanti, efficienti ed economiche, coltivate al buio per lasciare che il pianeta recuperi la luce.
Fonti e riferimenti
- Liu, X., et al. (2025). Dual enhancement of mycoprotein nutrition and sustainability via CRISPR-mediated metabolic engineering of Fusarium venenatum. Trends in Biotechnology.
- Finnigan, T., et al. (2019). Mycoprotein: The Future of Nutritious Nonmeat Protein, a Review. Current Developments in Nutrition.
- Regolamentazione e Mercato:
- Sull'approvazione normativa in Cina (2025): La Cina approva il suo primo ingrediente di micoproteina
- Sulla sicurezza alimentare: How gene-edited crops are regulated around the world (Nature).
- Wiebe, M. G. (2002). Myco-protein from Fusarium venenatum: a well-established product for human consumption. Applied Microbiology and Biotechnology.




















