Fusarium venenatum, le champignon qui défie l'industrie de la viande
L'industrie mondiale des protéines traverse une phase d'épuisement silencieux. Au cours de la dernière décennie, la réponse dominante à la crise environnementale et éthique de l'élevage a été la prolifération de produits végétaux imitant la viande : hamburgers de pois, saucisses de soja, matrices d'amidon et arômes reconstitués en laboratoire. Ils ont réussi à réduire les émissions et à ouvrir le débat, mais n'ont pas convaincu tout le monde. Ni au niveau du palais, ni des systèmes agricoles, ni des bilans énergétiques.
Dans ce contexte, la science a commencé à s'intéresser de plus près à un territoire qui n'est ni animal ni végétal : le règne fongique. Non pas comme une mode culinaire, mais comme une plateforme biotechnologique mature, capable de produire des protéines de haute qualité avec une efficacité métabolique que l'agriculture traditionnelle ne peut égaler.

Le point de bascule a eu lieu en novembre 2025. Une équipe de chercheurs de l'Université de Jiangnan (Chine), dirigée par le docteur Xiao Liu, a publié dans Trends in Biotechnology une avancée qui change la donne. Grâce à l'édition génétique de précision, ils ont réussi à optimiser le champignon Fusarium venenatum pour en faire une source de protéines nettement plus productive et moins chère. Il ne s'agissait pas d'une promesse futuriste, mais d'un déverrouillage moléculaire concret avec des résultats immédiats.
Redessiner le métabolisme fongique
La mycoprotéine n'est pas une découverte récente ni une réponse improvisée à l'anxiété climatique. Fusarium venenatum est une vieille connaissance identifiée comme candidat alimentaire dès les années soixante-dix, dans un contexte marqué par les crises énergétiques et la crainte de pénuries. Lorsqu'il est arrivé sur le marché dans les années quatre-vingt (sous des marques comme Quorn), sa proposition était radicale : produire des protéines dans des cuves de fermentation, sans champs, sans pâturages et sans animaux.
Cependant, cette première génération est arrivée avec ses limites. Sa production industrielle s'est toujours heurtée à une limite biologique : la vitesse à laquelle le champignon peut assimiler les nutriments, plus précisément l'azote. Pendant des décennies, le Fusarium a survécu comme une solution de niche, avec des coûts élevés et une efficacité qui peinait à décoller.
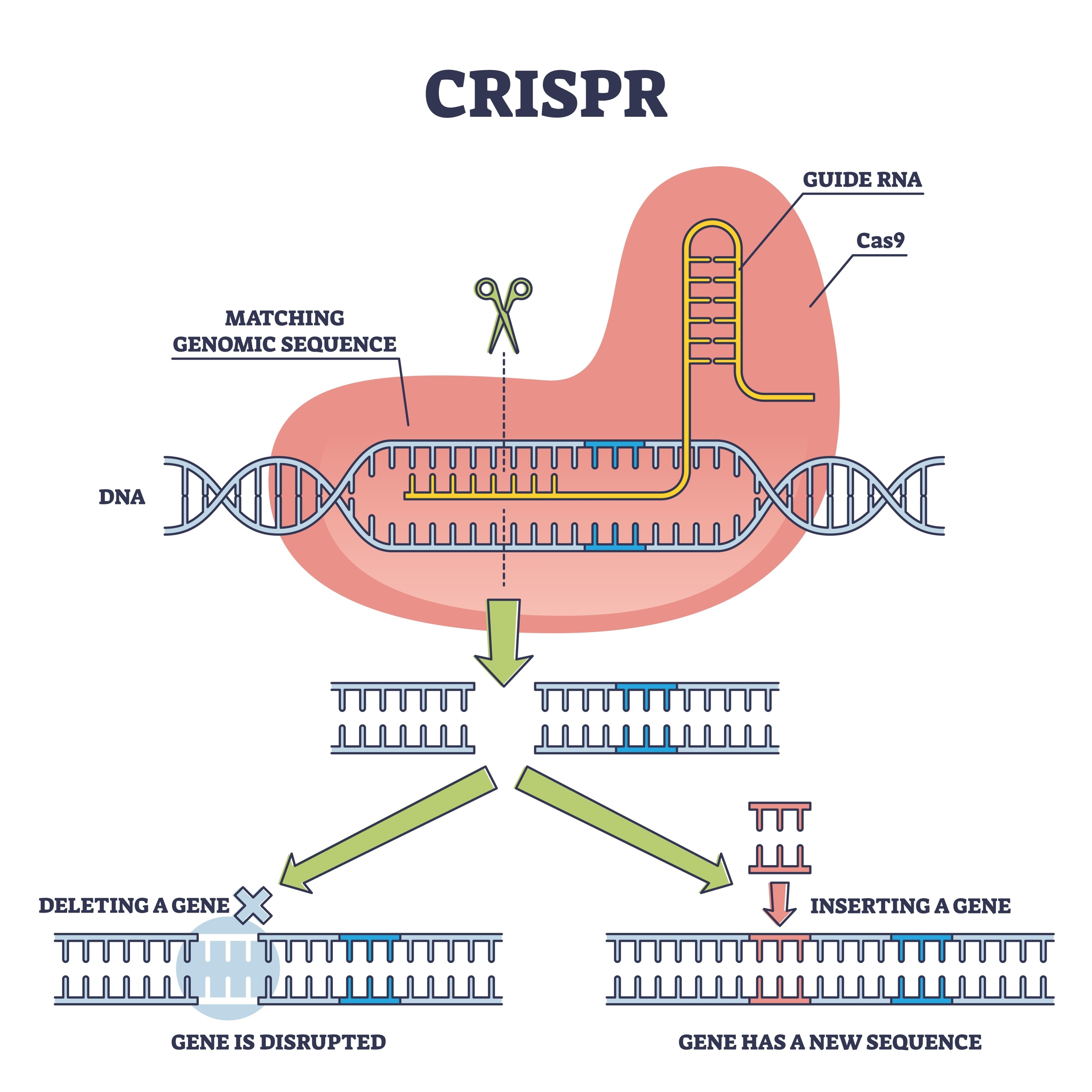
C'est ici qu'intervient l'équipe de Xiao Liu, qui a repêché cette technologie pour la mettre en état de rivaliser. Ils ont opté pour une stratégie de "cisgenèse". Contrairement aux transgéniques classiques, où l'on introduit de l'ADN d'autres espèces, l'outil CRISPR-Cas9 a été utilisé ici pour éditer des gènes qui existaient déjà dans le champignon. L'objectif était une famille de gènes spécifique : glnA, responsable de la production de la glutamine synthétase. Cette enzyme agit comme un "gardien" métabolique ; dans la souche sauvage, elle limite la quantité d'azote que le champignon absorbe pour construire des protéines.
En modifiant les promoteurs de ces gènes, les chercheurs ont réussi à retirer le "frein à main" de l'organisme. Le résultat est un champignon qui optimise son métabolisme interne pour cesser de réguler sa croissance à la baisse, convertissant les nutriments en biomasse avec une voracité inédite.
Augmentation de la biomasse et réduction des coûts
Dans l'industrie alimentaire, la durabilité est une équation mathématique. Si le produit final est cher ou lent à produire, il ne remplacera pas la viande. Les résultats présentés par l'Université de Jiangnan s'attaquent précisément à cette équation avec des chiffres percutants :
- Explosion de la croissance (+88 %) : Dans des conditions de culture identiques, la souche éditée double presque sa biomasse par rapport à la variante naturelle. Cela permet aux usines de fermentation de doubler leur production sans avoir à construire de nouveaux bioréacteurs, réduisant ainsi considérablement l'investissement en capital nécessaire.
- Économie de ressources (-44 %) : Le champignon modifié a nécessité près de moitié moins de sucre pour croître. Étant donné que le milieu de culture (l'"aliment" du champignon) représente l'un des coûts opérationnels les plus élevés, cette efficacité est la clé pour atteindre la parité des prix avec la viande industrielle bon marché.
Si l'on contextualise ces données, le fossé avec l'élevage s'agrandit. La production de cette mycoprotéine émet entre 60 et 70 % de gaz à effet de serre en moins que le bœuf et élimine de l'équation la déforestation et la consommation massive d'eau. C'est de la protéine industrialisée, certes, mais sans le fardeau écologique du modèle carné traditionnel.

Malgré tout, l'efficacité n'est pas une promesse automatique. En biotechnologie, les résultats de laboratoire ne survivent pas toujours au passage à l'échelle industrielle. Un organisme qui croît avec voracité dans des conditions contrôlées peut se comporter de manière imprévisible dans des fermentateurs de centaines de milliers de litres, soumis à des variations de température, d'oxygénation et à un stress métabolique prolongé.
Les auteurs de l'étude soulignent eux-mêmes que le prochain défi sera d'évaluer la stabilité génétique de la souche éditée à long terme, ainsi que son comportement lors de cycles continus de production. L'histoire de la biotechnologie alimentaire est pleine d'avancées brillantes qui ont échoué non pas par manque de science, mais à cause de limites pratiques. Ce Fusarium a gagné en vitesse ; il doit maintenant faire preuve d'endurance.
Mais produire plus de protéines ne sert à rien si le corps humain ne peut pas les assimiler. Et c'est là que la biologie du champignon posait, jusqu'à présent, l'une de ses plus grandes limites.
Plus nutritif et digeste : comment l'édition génétique redessine la fibre fongique
Le consommateur n'achète pas des protéines ; il achète une expérience. Fibres, mâche, jutosité. C'est ici que la biologie du champignon offre un avantage structurel : il croît en formant des hyphes, des filaments microscopiques qui imitent naturellement la disposition des fibres musculaires animales.
Cependant, cette architecture avait un prix caché : la biodisponibilité. Les cellules des champignons sont protégées par des parois rigides de chitine — le même matériau que l'exosquelette des insectes. Jusqu'à présent, pour le système digestif humain, briser cette "armure" s'avérait complexe, ce qui empêchait d'accéder à une grande partie de la protéine que le champignon stocke à l'intérieur. Nous avions un aliment riche en théorie, mais pas toujours exploité avec l'efficacité que sa composition promettait.
L'équipe de Jiangnan a abordé cet obstacle avec une deuxième série d'édition génétique, parallèle à celle de la croissance. Ils ont éliminé les gènes associés à la chitine synthétase, réduisant ainsi considérablement l'épaisseur de la paroi cellulaire.
Le résultat est un équilibre biotechnologique délicat : les hyphes maintiennent leur structure entrelacée (préservant la texture carnée), mais leurs murs défensifs sont désormais plus fins. En "amincissant" cette barrière, les chercheurs ont libéré la protéine intracellulaire pour que notre corps puisse réellement l'absorber. Ce n'est plus seulement un aliment qui "remplit" grâce à ses fibres, mais un aliment qui nourrit avec l'efficacité promise.
Bien que l'étude de Liu se soit concentrée sur la croissance et la digestibilité, le domaine progresse vers l'amélioration du goût. D'autres recherches récentes utilisent des techniques similaires pour induire la production d'hémoprotéines — responsables du goût métallique de la viande —, promettant de combler le fossé sensoriel définitif entre le fermentateur et l'abattoir.
Mise à l'échelle industrielle et cadre réglementaire
Ce n'est pas un hasard si cette avancée provient de Chine. Au cours de la dernière décennie, le pays a identifié la fermentation de précision comme une technologie stratégique, capable de réduire sa dépendance aux importations agricoles et d'amortir la volatilité des marchés mondiaux des protéines.
La protéine fongique ne rivalise pas seulement avec la viande : elle rivalise avec le modèle agricole extensif, avec la logistique mondiale et avec la géopolitique de l'alimentation. Sur cet échiquier, les bioréacteurs deviennent des infrastructures aussi critiques que les silos à grains ou les ports commerciaux.

L'avancée scientifique est indéniable, mais le chemin vers le supermarché passe par la bureaucratie. Cependant, la technique choisie par l'équipe de Xiao Liu pourrait faciliter le processus. En n'incorporant pas d'ADN exogène, ces champignons se situent dans une zone réglementaire favorable dans des régions comme les États-Unis et, de plus en plus, dans l'Union européenne, où l'on commence à distinguer entre organismes génétiquement modifiés (OGM) classiques et organismes édités (NGT). La logique est que, en n'introduisant pas de matériel génétique d'espèces étrangères, le résultat final est considéré comme biologiquement équivalent à une mutation qui aurait pu se produire dans la nature. Cela permet d'éviter les protocoles de sécurité stricts et coûteux exigés pour les transgéniques classiques.
Dans une usine de fermentation, il n'y a ni prés ni enclos. Seulement des cuves en acier, des tuyaux et un murmure constant de liquides en mouvement. Le champignon croît sans voir la lumière du soleil, transformant sucres et azote en fibres comestibles avec une efficacité qu'aucun animal ne peut répliquer. Il n'y a ni sacrifice ni épopée rurale : seulement un métabolisme optimisé.
C'est peut-être la raison pour laquelle cette révolution avance en silence. Elle ne fait appel ni à la nostalgie ni à l'émotion, mais à une question inconfortable : que sommes-nous prêts à laisser derrière nous pour continuer à nous nourrir sans épuiser la planète.
Dans un monde qui approche des dix milliards d'habitants, la question n'est peut-être pas de savoir si nous accepterons de manger des champignons, mais quelles autres idées sur la nourriture nous devrons abandonner pour continuer à nous nourrir sans épuiser la planète. La proposition de Liu offre une solution sobre : une protéine abondante, efficace et bon marché, cultivée dans l'obscurité pour laisser la planète retrouver la lumière.
Sources et références
- Liu, X., et al. (2025). Dual enhancement of mycoprotein nutrition and sustainability via CRISPR-mediated metabolic engineering of Fusarium venenatum. Trends in Biotechnology.
- Finnigan, T., et al. (2019). Mycoprotein: The Future of Nutritious Nonmeat Protein, a Review. Current Developments in Nutrition.
- Réglementation et Marché :
- Sur l'approbation réglementaire en Chine (2025) : La Chine approuve son premier ingrédient de mycoprotéine
- Sur la sécurité alimentaire : How gene-edited crops are regulated around the world (Nature).
- Wiebe, M. G. (2002). Myco-protein from Fusarium venenatum: a well-established product for human consumption. Applied Microbiology and Biotechnology.




















