Fusarium venenatum, el hongo que desafía la eficiencia de la industria cárnica
La industria global de la proteína atraviesa una fase de agotamiento silencioso. Durante la última década, la respuesta dominante a la crisis ambiental y ética de la ganadería ha sido la proliferación de productos vegetales que imitan la carne: hamburguesas de guisante, salchichas de soja, matrices de almidón y aromas reconstruidos en laboratorio. Han logrado reducir emisiones y abrir el debate, pero no han convencido a todos. Ni al paladar, ni a los sistemas agrícolas, ni a los balances energéticos.
En ese contexto, la ciencia ha comenzado a mirar con mayor atención a un territorio que no es ni animal ni vegetal: el reino fungi. No como una moda culinaria, sino como una plataforma biotecnológica madura, capaz de producir proteína de alta calidad con una eficiencia metabólica que la agricultura tradicional no puede igualar.

El punto de inflexión llegó en noviembre de 2025. Un equipo de investigadores de la Universidad de Jiangnan (China), liderado por el doctor Xiao Liu, publicó en Trends in Biotechnology un avance que cambia las reglas del juego. Utilizando edición genética de precisión, lograron optimizar el hongo Fusarium venenatum para convertirlo en una fuente de proteína significativamente más productiva y barata. No se trató de una promesa futurista, sino de un desbloqueo molecular concreto con resultados inmediatos.
Rediseñar el metabolismo fúngico
La micoproteína no es un descubrimiento reciente ni una respuesta improvisada a la ansiedad climática. Fusarium venenatum es un viejo conocido identificado como candidato alimentario ya en los años setenta, en un contexto marcado por crisis energéticas y temor al desabastecimiento. Cuando llegó al mercado en los años ochenta (bajo marcas como Quorn), su propuesta era radical: producir proteína en tanques de fermentación, sin campo, sin pastos y sin animales.
Sin embargo, aquella primera generación llegó con limitaciones. Su producción industrial siempre ha chocado con un límite biológico: la velocidad a la que el hongo puede asimilar nutrientes, específicamente el nitrógeno. Durante décadas, Fusarium sobrevivió como una solución de nicho, con costes elevados y una eficiencia que no terminaba de despegar.
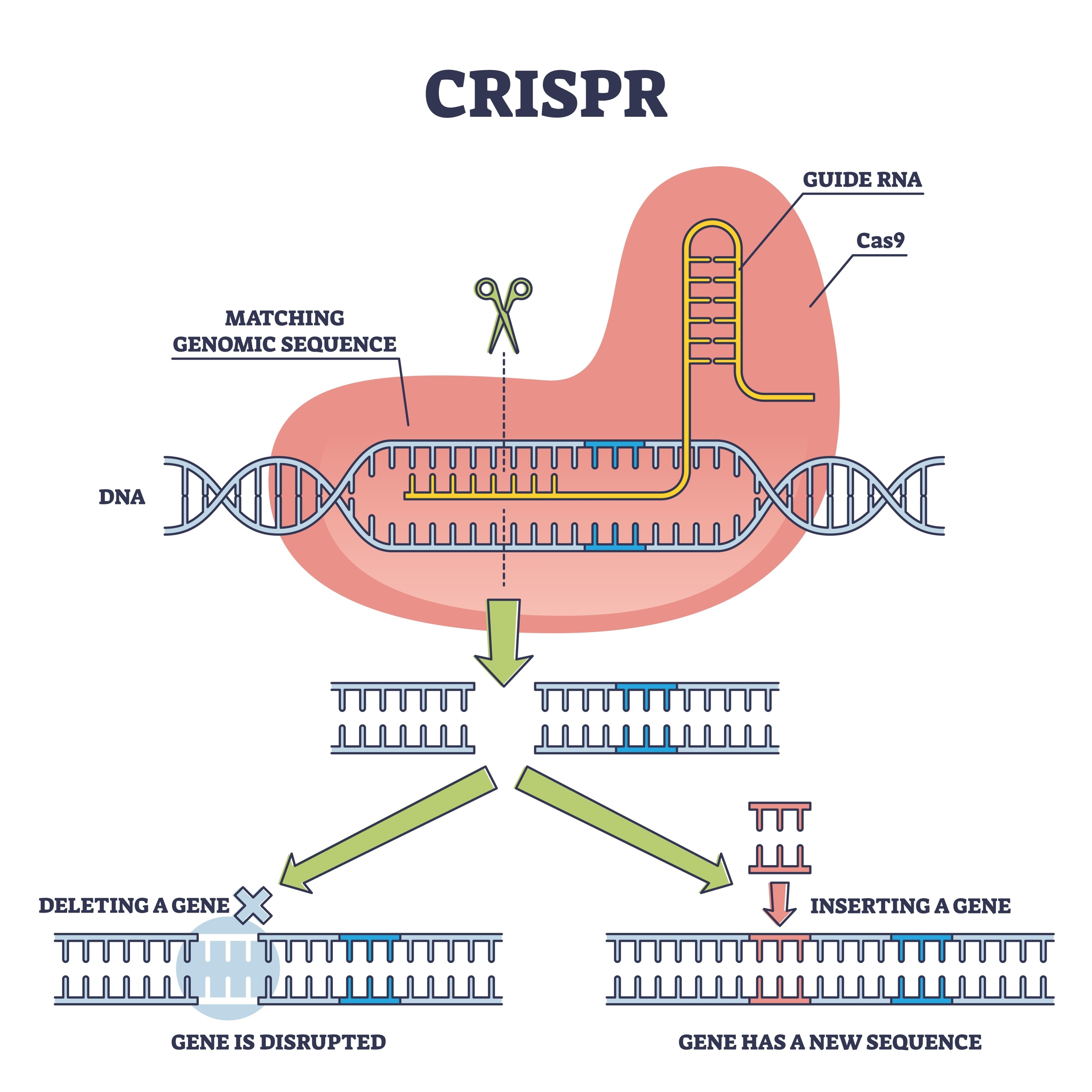
Aquí es donde entra el equipo de Xiao Liu, rescatando esta tecnología para colocarla en condiciones de competir. Optaron por una estrategia de "cisgénesis". A diferencia de los transgénicos clásicos, donde se introduce ADN de otras especies, aquí se utilizó la herramienta CRISPR-Cas9 para editar genes que ya existían en el hongo. El objetivo fue una familia génica concreta: glnA, responsable de la producción de la glutamina sintetasa. Esta enzima actúa como "portero" metabólico; en la cepa silvestre, limita la cantidad de nitrógeno que el hongo absorbe para construir proteínas.
Al modificar los promotores de estos genes, los investigadores lograron quitarle el "freno de mano" al organismo. El resultado es un hongo que optimiza su metabolismo interno para dejar de regular su crecimiento a la baja, convirtiendo los nutrientes en biomasa con una voracidad inédita.
Incremento de biomasa y reducción de costes
En la industria alimentaria, la sostenibilidad es una ecuación matemática. Si el producto final es caro o lento de producir, no sustituirá a la carne. Los resultados presentados por la Universidad de Jiangnan atacan precisamente esa ecuación con cifras contundentes:
- Explosión de crecimiento (+88 %): En condiciones de cultivo idénticas, la cepa editada casi duplica su biomasa respecto a la variante natural. Esto permite a las plantas de fermentación duplicar su producción sin necesidad de construir nuevos biorreactores, reduciendo drásticamente la inversión de capital necesaria.
- Ahorro de recursos (-44 %): El hongo modificado necesitó casi la mitad de azúcar para crecer. Dado que el medio de cultivo (el "alimento" del hongo) representa uno de los mayores costes operativos, esta eficiencia es la llave para alcanzar la paridad de precios con la carne industrial barata.
Si contextualizamos estos datos, el abismo con la ganadería se agranda. La producción de esta micoproteína emite entre un 60 y un 70 % menos de gases de efecto invernadero que el vacuno y elimina de la ecuación la deforestación y el consumo masivo de agua. Es proteína industrializada, sí, pero sin el lastre ecológico del modelo cárnico tradicional.

Aun así, la eficiencia no es una promesa automática. En biotecnología, los resultados de laboratorio no siempre sobreviven al salto a escala industrial. Un organismo que crece con voracidad en condiciones controladas puede comportarse de forma imprevisible en fermentadores de cientos de miles de litros, sometidos a variaciones de temperatura, oxigenación y estrés metabólico prolongado.
Los propios autores del estudio señalan que el siguiente desafío será evaluar la estabilidad genética de la cepa editada a largo plazo, así como su comportamiento en ciclos continuos de producción. La historia de la biotecnología alimentaria está llena de avances brillantes que fracasaron no por falta de ciencia, sino por límites prácticos. Este Fusarium ha ganado velocidad; ahora debe demostrar resistencia.
Pero producir más proteína no sirve de nada si el cuerpo humano no puede aprovecharla. Y ahí es donde la biología del hongo planteaba, hasta ahora, uno de sus mayores límite.
Más nutritivo y digerible: cómo la edición genética rediseña la fibra fúngica
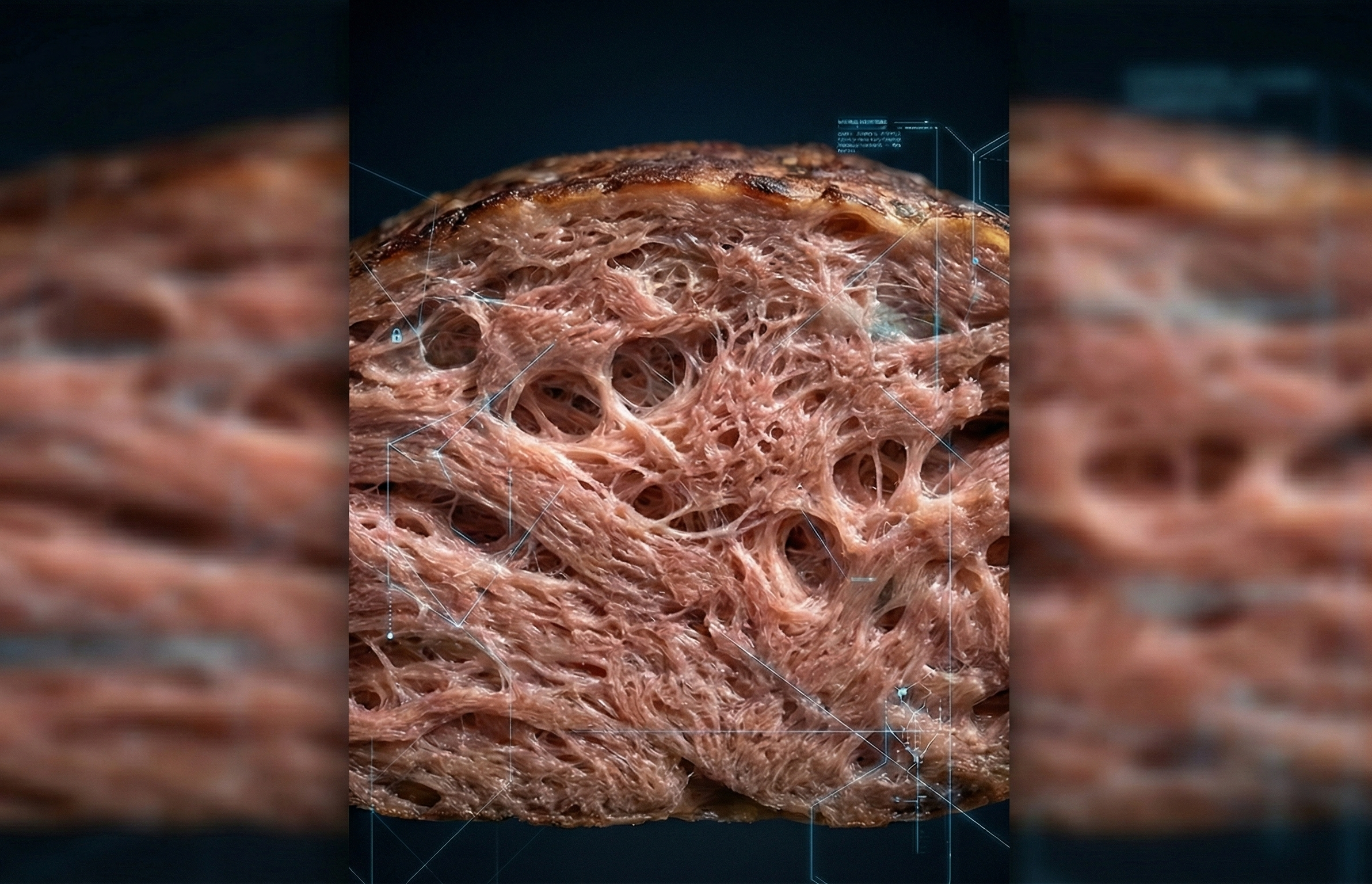
El consumidor no compra proteínas; compra experiencia. Fibra, mordida, jugosidad. Aquí es donde la biología del hongo ofrece una ventaja estructural: crece formando hifas, filamentos microscópicos que imitan de forma natural la disposición de las fibras musculares animales.
Sin embargo, esa arquitectura tenía un precio oculto: la biodisponibilidad. Las células de los hongos están protegidas por paredes rígidas de quitina —el mismo material del exoesqueleto de los insectos—. Hasta ahora, para el sistema digestivo humano, romper esa "armadura" resultaba complejo, lo que impedía acceder a gran parte de la proteína que el hongo almacena en su interior. Teníamos un alimento rico en teoría, pero no siempre aprovechado con la eficiencia que su composición prometía.
El equipo de Jiangnan abordó este obstáculo con una segunda ronda de edición genética, paralela a la del crecimiento. Eliminaron los genes asociados a la quitina sintasa, reduciendo significativamente el grosor de la pared celular.
El resultado es un equilibrio biotecnológico delicado: las hifas mantienen su estructura entrelazada (preservando la textura cárnica), pero sus muros defensivos son ahora más finos. Al "adelgazar" esa barrera, los investigadores liberaron la proteína intracelular para que nuestro cuerpo pueda absorberla realmente. Ya no es solo un alimento que "llena" por su fibra, sino uno que nutre con la eficiencia prometida.
Aunque el estudio de Liu se centró en crecimiento y digestibilidad, el campo avanza hacia el sabor. Otras investigaciones recientes utilizan técnicas similares para inducir la producción de hemoproteínas —responsables del gusto metálico de la carne—, prometiendo cerrar la brecha sensorial definitiva entre el fermentador y el matadero.
Escalado industrial y marco regulatorio
No es casual que este avance provenga de China. En la última década, el país ha identificado la fermentación de precisión como una tecnología estratégica, capaz de reducir su dependencia de importaciones agrícolas y amortiguar la volatilidad de los mercados globales de proteína.
La proteína fúngica no solo compite con la carne: compite con el modelo agrícola extensivo, con la logística global y con la geopolítica del alimento. En ese tablero, los biorreactores se convierten en infraestructuras tan críticas como los silos de grano o los puertos comerciales.

El avance científico es innegable, pero el camino al supermercado pasa por la burocracia. Sin embargo, la técnica elegida por el equipo de Xiao Liu podría facilitar el proceso. Al no incorporar ADN exógeno, estos hongos se sitúan en una zona regulatoria favorable en regiones como Estados Unidos y, cada vez más, en la Unión Europea, donde se empieza a distinguir entre organismos modificados genéticamente (OMG) clásicos y organismos editados (NGT). La lógica es que, al no introducir material genético de especies extrañas, el resultado final se considera biológicamente equivalente a una mutación que podría haber ocurrido en la naturaleza. Esto permite evitar los estrictos y costosos protocolos de seguridad exigidos a los transgénicos clásicos.
En una planta de fermentación, no hay prados ni corrales. Solo tanques de acero, tuberías y un murmullo constante de líquidos en movimiento. El hongo crece sin ver la luz del sol, transformando azúcares y nitrógeno en fibras comestibles con una eficiencia que ningún animal puede replicar. No hay sacrificio ni épica rural: solo metabolismo optimizado.
Quizá esa sea la razón por la que esta revolución avanza en silencio. No apela a la nostalgia ni a la emoción, sino a una pregunta incómoda: qué estamos dispuestos a dejar atrás para seguir alimentándonos sin agotar el planeta.
En un mundo que se aproxima a los diez mil millones de habitantes, la pregunta tal vez no sea si aceptaremos comer hongos, sino qué otras ideas sobre la comida tendremos que abandonar para seguir alimentándonos sin agotar el planeta. La propuesta de Liu ofrece una solución sobria: proteína abundante, eficiente y barata, cultivada en la oscuridad para dejar que el planeta recupere la luz.
Fuentes y referencias
- Liu, X., et al. (2025). Dual enhancement of mycoprotein nutrition and sustainability via CRISPR-mediated metabolic engineering of Fusarium venenatum. Trends in Biotechnology.
- Finnigan, T., et al. (2019). Mycoprotein: The Future of Nutritious Nonmeat Protein, a Review. Current Developments in Nutrition.
- Regulación y Mercado:
- Sobre la aprobación regulatoria en China (2025): China aprueba su primer ingrediente de micoproteína
- Sobre seguridad alimentaria: How gene-edited crops are regulated around the world (Nature).
- Wiebe, M. G. (2002). Myco-protein from Fusarium venenatum: a well-established product for human consumption. Applied Microbiology and Biotechnology.




















