Fusarium venenatum, o fungo que desafia a eficiência da indústria da carne
A indústria global da proteína atravessa uma fase de esgotamento silencioso. Durante a última década, a resposta dominante à crise ambiental e ética da pecuária tem sido a proliferação de produtos vegetais que imitam a carne: hambúrgueres de ervilha, salsichas de soja, matrizes de amido e aromas reconstruídos em laboratório. Conseguiram reduzir emissões e abrir o debate, mas não convenceram a todos. Nem ao paladar, nem aos sistemas agrícolas, nem aos balanços energéticos.
Nesse contexto, a ciência começou a olhar com maior atenção para um território que não é nem animal nem vegetal: o reino fungi. Não como uma moda culinária, mas como uma plataforma biotecnológica madura, capaz de produzir proteína de alta qualidade com uma eficiência metabólica que a agricultura tradicional não pode igualar.

O ponto de inflexão chegou em novembro de 2025. Uma equipa de investigadores da Universidade de Jiangnan (China), liderada pelo doutor Xiao Liu, publicou na Trends in Biotechnology um avanço que muda as regras do jogo. Utilizando edição genética de precisão, conseguiram otimizar o fungo Fusarium venenatum para convertê-lo numa fonte de proteína significativamente mais produtiva e barata. Não se tratou de uma promessa futurista, mas de um desbloqueio molecular concreto com resultados imediatos.
Redesenhar o metabolismo fúngico
A micoproteína não é uma descoberta recente nem uma resposta improvisada à ansiedade climática. Fusarium venenatum é um velho conhecido identificado como candidato alimentar já nos anos setenta, num contexto marcado por crises energéticas e temor ao desabastecimento. Quando chegou ao mercado nos anos oitenta (sob marcas como Quorn), a sua proposta era radical para a época: produzir proteína em tanques de fermentação, sem campo, sem pastos e sem animais.
No entanto, aquela primeira geração chegou com limitações. A sua produção industrial sempre chocou com um limite biológico: a velocidade a que o fungo pode assimilar nutrientes, especificamente o nitrogénio. Durante décadas, o Fusarium sobreviveu como uma solução de nicho, com custos elevados e uma eficiência que não acabava de descolar.
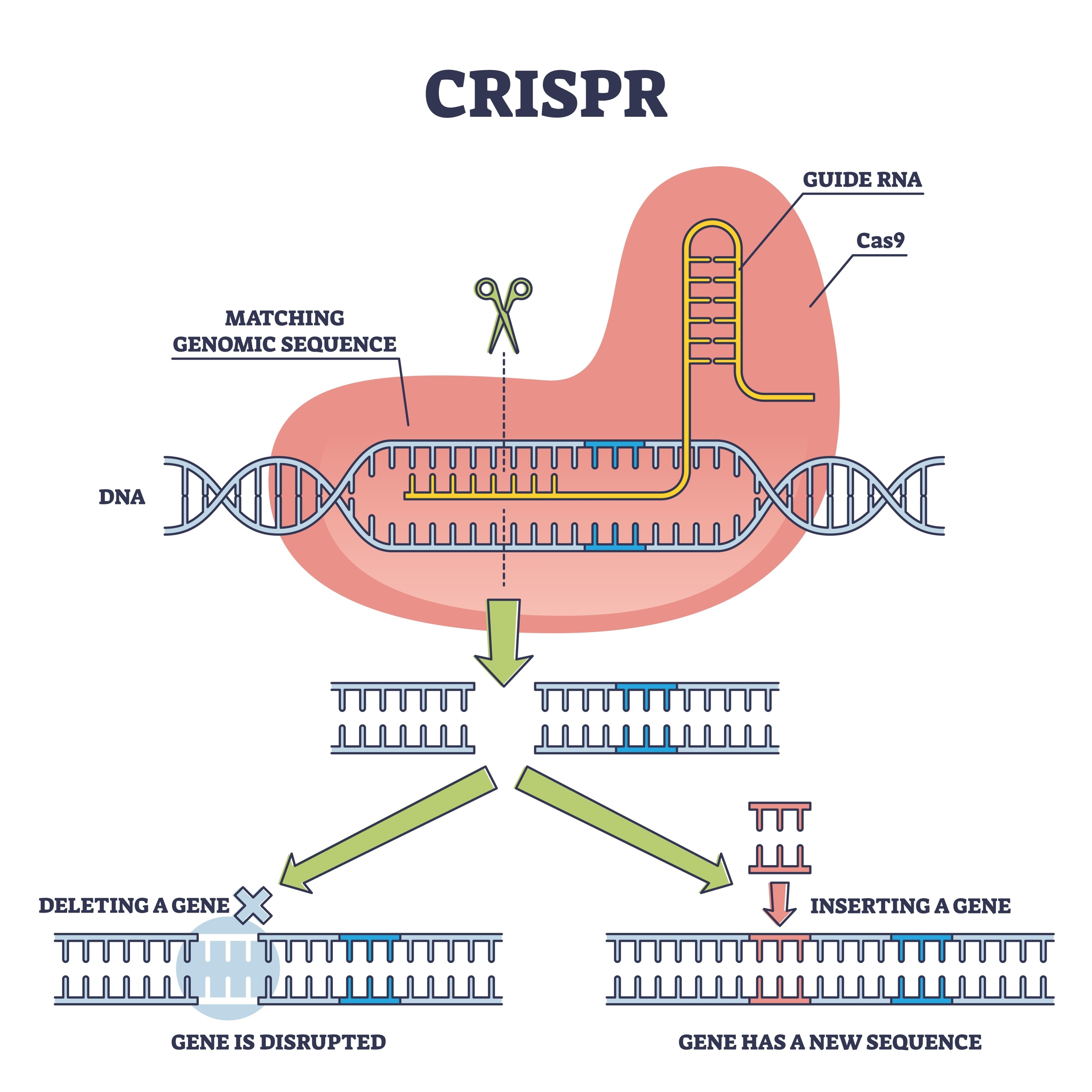
Aqui é onde entra a equipa de Xiao Liu, resgatando esta tecnologia para colocá-la em condições de competir. Optaram por uma estratégia de "cisgénese". Ao contrário dos transgénicos clássicos, onde se introduz ADN de outras espécies, aqui utilizou-se a ferramenta CRISPR-Cas9 para editar genes que já existiam no fungo. O objetivo foi uma família génica concreta: glnA, responsável pela produção da glutamina sintetase. Esta enzima atua como "porteiro" metabólico; na estirpe selvagem, limita a quantidade de nitrogénio que o fungo absorve para construir proteínas.
Ao modificar os promotores destes genes, os investigadores conseguiram tirar o "travão de mão" ao organismo. O resultado é um fungo que otimiza o seu metabolismo interno para deixar de regular o seu crescimento por baixo, convertendo os nutrientes em biomassa com uma voracidade inédita.
Aumento de biomassa e redução de custos
Na indústria alimentar, a sustentabilidade é uma equação matemática. Se o produto final é caro ou lento de produzir, não substituirá a carne. Os resultados apresentados pela Universidade de Jiangnan atacam precisamente essa equação com números contundentes:
- Explosão de crescimento (+88 %): Em condições de cultivo idênticas, a estirpe editada quase duplica a sua biomassa em relação à variante natural. Isto permite às plantas de fermentação duplicar a sua produção sem necessidade de construir novos biorreatores, reduzindo drasticamente o investimento de capital necessário.
- Poupança de recursos (-44 %): O fungo modificado necessitou de quase metade do açúcar para crescer. Dado que o meio de cultura (o "alimento" do fungo) representa um dos maiores custos operacionais, esta eficiência é a chave para alcançar a paridade de preços com a carne industrial barata.
Se contextualizarmos estes dados, o abismo com a pecuária aumenta. A produção desta micoproteína emite entre 60 e 70% menos gases de efeito estufa do que a carne de bovino e elimina da equação a desflorestação e o consumo massivo de água. É proteína industrializada, sim, mas sem o lastro ecológico do modelo de carne tradicional.

Ainda assim, a eficiência não é uma promessa automática. Em biotecnologia, os resultados de laboratório nem sempre sobrevivem ao salto para a escala industrial. Um organismo que cresce com voracidade em condições controladas pode comportar-se de forma imprevisível em fermentadores de centenas de milhares de litros, submetidos a variações de temperatura, oxigenação e stress metabólico prolongado.
Os próprios autores do estudo assinalam que o próximo desafio será avaliar a estabilidade genética da estirpe editada a longo prazo, bem como o seu comportamento em ciclos contínuos de produção. A história da biotecnologia alimentar está cheia de avanços brilhantes que fracassaram não por falta de ciência, mas por limites práticos. Este Fusarium ganhou velocidade; agora deve demonstrar resistência.
Mas produzir mais proteína não serve de nada se o corpo humano não puder aproveitá-la. E aí é onde a biologia do fungo colocava, até agora, um dos seus maiores limites.
Mais nutritivo e digerível: como a edição genética redesenha a fibra fúngica
O consumidor não compra proteínas; compra experiência. Fibra, mordida, suculência. Aqui é onde a biologia do fungo oferece uma vantagem estrutural: cresce formando hifas, filamentos microscópicos que imitam de forma natural a disposição das fibras musculares animais.
No entanto, essa arquitetura tinha um preço oculto: a biodisponibilidade. As células dos fungos estão protegidas por paredes rígidas de quitina — o mesmo material do exosqueleto dos insetos. Até agora, para o sistema digestivo humano, romper essa "armadura" revelava-se complexo, o que impedia o acesso a grande parte da proteína que o fungo armazena no seu interior. Tínhamos um alimento rico na teoria, mas nem sempre aproveitado com a eficiência que a sua composição prometia.
A equipa de Jiangnan abordou este obstáculo com uma segunda ronda de edição genética, paralela à do crescimento. Eliminaram os genes associados à quitina sintase, reduzindo significativamente a espessura da parede celular.
O resultado é um equilíbrio biotecnológico delicado: as hifas mantêm a sua estrutura entrelaçada (preservando a textura de carne), mas os seus muros defensivos são agora mais finos. Ao "afinar" essa barreira, os investigadores libertaram a proteína intracelular para que o nosso corpo possa absorvê-la realmente. Já não é apenas um alimento que "enche" pela sua fibra, mas um que nutre com a eficiência prometida.
Embora o estudo de Liu se tenha centrado no crescimento e digestibilidade, o campo avança em direção ao sabor. Outras investigações recentes utilizam técnicas semelhantes para induzir a produção de hemoproteínas — responsáveis pelo gosto metálico da carne —, prometendo fechar a brecha sensorial definitiva entre o fermentador e o matadouro.
Escala industrial e quadro regulatório
Não é por acaso que este avanço provenha da China. Na última década, o país identificou a fermentação de precisão como uma tecnologia estratégica, capaz de reduzir a sua dependência de importações agrícolas e amortecer a volatilidade dos mercados globais de proteína.
A proteína fúngica não compete apenas com a carne: compete com o modelo agrícola extensivo, com a logística global e com a geopolítica do alimento. Nesse tabuleiro, os biorreatores convertem-se em infraestruturas tão críticas como os silos de cereais ou os portos comerciais.

O avanço científico é inegável, mas o caminho até ao supermercado passa pela burocracia. No entanto, a técnica escolhida pela equipa de Xiao Liu poderia facilitar o processo. Ao não incorporar ADN exógeno, estes fungos situam-se numa zona regulatória favorável em regiões como os Estados Unidos e, cada vez mais, na União Europeia, onde se começa a distinguir entre organismos modificados geneticamente (OMG) clássicos e organismos editados (NGT). A lógica é que, ao não introduzir material genético de espécies estranhas, o resultado final considera-se biologicamente equivalente a uma mutação que poderia ter ocorrido na natureza. Isto permite esquivar os estritos e dispendiosos protocolos de segurança exigidos aos transgénicos clássicos.
Numa planta de fermentação, não há prados nem currais. Apenas tanques de aço, tubagens e um murmúrio constante de líquidos em movimento. O fungo cresce sem ver a luz do sol, transformando açúcares e nitrogénio em fibras comestíveis com uma eficiência que nenhum animal pode replicar. Não há sacrifício nem épica rural: apenas metabolismo otimizado.
Talvez seja essa a razão pela qual esta revolução avança em silêncio. Não apela à nostalgia nem à emoção, mas a uma pergunta incómoda: o que estamos dispostos a deixar para trás para continuar a alimentar-nos sem esgotar o planeta.
Num mundo que se aproxima dos dez mil milhões de habitantes, a pergunta talvez não seja se aceitaremos comer fungos, mas que outras ideias sobre a comida teremos de abandonar para continuar a alimentar-nos sem esgotar o planeta. A proposta de Liu oferece uma solução sóbria: proteína abundante, eficiente e barata, cultivada no escuro para deixar o planeta recuperar a luz.
Fontes e referências
- Liu, X., et al. (2025). Dual enhancement of mycoprotein nutrition and sustainability via CRISPR-mediated metabolic engineering of Fusarium venenatum. Trends in Biotechnology.
- Finnigan, T., et al. (2019). Mycoprotein: The Future of Nutritious Nonmeat Protein, a Review. Current Developments in Nutrition.
- Regulação e Mercado:
- Sobre a aprovação regulatória na China (2025): China aprova o seu primeiro ingrediente de micoproteína
- Sobre segurança alimentar: How gene-edited crops are regulated around the world (Nature).
- Wiebe, M. G. (2002). Myco-protein from Fusarium venenatum: a well-established product for human consumption. Applied Microbiology and Biotechnology.




















